Découvrez l’interview d’une infirmière coordinatrice de notre service Home Nursing 🧑🏼⚕️
Nous avons eu le plaisir d’échanger avec Séverine Venel qui partage avec nous son parcours, ses défis quotidiens et la passion qui l’anime pour le bien-être des patients à domicile. 💙
🔹 Pourquoi rejoindre la #TeamEuraxi ?
🔹 Quel parcours de formation ?
🔹 Quelles missions ?
🔹 Les qualités requises ?
Autant de questions auxquelles Séverine répond avec authenticité et enthousiasme. Cette vidéo est l’occasion de mettre en lumière le dévouement de nos équipes qui œuvrent chaque jour pour offrir un service de qualité et un accompagnement personnalisé aux patients.
Retrouvez nous durant la journée CDISC – Life Science qui aura lieu le 15 juin 2023 à la Faculté de Médecine de Tours.
Nous vous y attendons nombreux(ses) !
Cécile Bultez, rédactrice médicale chez Euraxi, a rédigé un article qui vient d’être publié dans la revue en ligne DeviceMed ! 📚
Cet article met en lumière notre expertise dans le domaine des opérations cliniques et fournit des informations précieuses pour mener une évaluation clinique réussie d’un dispositif médical numérique.

Comme chaque année nous participons à la journée de la recherche clinique, qui aura lieu le jeudi 16 mars 2023 au Hyatt Paris Etoile.
Nous profitions de cette journée pour organiser un 🌈 TIRAGE AU SORT 🎲
>>> Un événement à ne pas manquer !!
Cela vous tente ?
Nous sommes joueurs chez Euraxi et nous avons envie de vous faire gagner des cadeaux 🎁
✅ Déposez votre carte de visite dans l’urne présente sur notre stand le jeudi 16 mars
👉 Vous aurez ainsi la possibilité d’être tiré au sort et de gagner🤞
⏰ Début du concours : le 16 mars !
⏰ Fin du concours à la fin de la Journée de la Recherche Clinique
👉 Au plaisir d’échanger avec vous 🙂
À très bientôt !
#tirageausort #jeu #salon #clinicalresearch #euraxi
En savoir plus sur la journée de la recherche clinique : https://journee-recherche-clinique.fr/
Règlement du concours :
Article 1 – Organisateur
Euraxi Pharma, société au capital 1 974 826,00 € euros, immatriculée au Registre du Commerce et des Sociétés de Tours 420 965 758 R.C.S. Tours – dont le siège social se trouve au 10 rue Gutenberg 37303 Joué-lès-Tours Cedex (ci-après le « Euraxi » ou la « Société Organisatrice »).
Article 2 – Objet
Euraxi organise tout au long de l’année des jeux consistant en des tirages au sort qui se déroulent sur différents lieux physiques tels que les salons, foires et partenaires locaux (ci-après le « Jeu »).
La participation au Jeu est gratuite et sans obligation d’achat.
Article 3 – Durée
Le présent règlement s’applique à toutes les opérations de tirages au sort organisées par Euraxi à compter du 28/02/2023.
Chaque session de Jeu est organisée pour une durée limitée fixée par la Société Organisatrice et correspondant généralement à la durée de l’évènement local.
Article 4 – Conditions de participation
Les tirages au sort sont ouverts à toute personne physique majeure, (ci-après « Participant »), à l’exception des collaborateurs de la Société Organisatrice ayant participé directement à l’organisation, à la promotion et/ou à la réalisation des tirages au sort.
En raison des spécificités du Jeu, les Participants ne peuvent y participer qu’au moyen d’une présence physique, en se présentant à l’urne « unique » disponible sur chaque lieu de la session de Jeu.
La participation au Jeu est limitée à une (1) participation par personne. En cas de participation multiple d’une même personne, cette dernière sera éliminée d’office du Jeu. Les bulletins de participation aux tirages au sort seront distribués gratuitement et sans obligation d’achat sur les lieux des évènements.
Article 5 – Accès au jeu
Toute participation au Jeu nécessite de se rendre physiquement sur le lieu où se déroule l’évènement local.
La Participation au Jeu implique l’acceptation pleine et entière du présent règlement et de ses annexes éventuelles.
Article 6 – Déroulement du Jeu
Le Jeu se déroule comme suit :
– une urne est installée physiquement sur le lieu de l’évènement pendant toute la durée de la manifestation.
– pour jouer, le Participant doit remplir un bulletin de participation au tirage au sort , avec les informations obligatoires suivantes : nom, prénom, date de naissance, numéro de téléphone, profession, nom de l’entreprise, adresse n° et rue, code postal, ville et adresse email, qu’il doit déposer par la suite dans l’urne. Il peut également une carte de visite reprenant ces informations.
En l’absence des informations obligatoires demandées ou en cas de fourniture d’informations incorrectes, incomplètes ou inexactes, l’inscription au Jeu ne pourra être prise en compte.
Une fois le Jeu terminé, un représentant d’Euraxi procèdera à un tirage au sort qui aura lieu dans les conditions fixées à l’article 7 ci-dessous.
Article 7 – Désignation du gagnant
Un gagnant par session de Jeu sera désigné par tirage au sort parmi les bulletins de participation/carte de visite mis dans l’urne.
Le tirage au sort sera réalisé par un représentant d’Euraxi au plus tard une semaine après la fin du Jeu.
Le représentant d’Euraxi avertira le gagnant par téléphone ou par email et le lot sera remis en main propre ou par courrier au gagnant.
Article 8 – Les lots
Le gagnant du Jeu, tel que désigné à l’article 7, se verra attribuer un lot défini en amont de la session de Jeu. La valeur du lot varie selon l’évènement, et est comprise entre 10 euros et 300 euros. Les personnes représentant Euraxi communiquerons le lot en jeu le jour de l’évènement.
Les lots offerts ne peuvent donner lieu, de la part des gagnants, à aucune contestation d’aucune sorte, ni à la remise de leur contre-valeur en argent, ni à leur remplacement ou échange pour quelque cause que ce soit. Aucun frais d’acheminement/transport ne sera pris en charge par la Société Organisatrice.
La Société Organisatrice se réserve le droit de substituer, à tout moment, à l’un des prix proposés, un prix de nature et de valeurs équivalentes.
Article 9 – Information des gagnants et remise des prix
La remise du lot aura lieu à l’issue de chaque tirage au sort. Le gagnant de chaque session sera avisé par téléphone ou par email de son gain et des modalités de sa remise dans un délai de 48h à l’issue de chaque tirage au sort. La pièce d’identité présentée doit être celle du gagnant.
Si le gagnant ne se manifeste pas dans le mois suivant la notification de son gain, il sera considéré comme ayant renoncé à son lot, lequel restera la propriété de la Société Organisatrice.
Article 10 – Communication de l’identité du gagnant
Le gagnant de chaque session de Jeu autorise Euraxi à utiliser les informations nécessaires à son identification (première lettre des nom, prénom, code postal) dans le cadre d’actions publicitaires, promotionnelles et/ou d’information du public pour le présent Jeu ou d’autres concours similaires organisés par Euraxi, quel que soit le support de diffusion (tout document imprimé, presse, affichage, radio, TV, Internet y compris les sites communautaires etc.), durant un (1) an à compter de la date de début de chaque session de Jeu et sans que cette utilisation ne puisse ouvrir d’autres droits que le lot gagné.
Article 11 – Respect de l’intégrité du Jeu
Le Participant s’interdit de mettre en oeuvre ou de chercher à mettre en oeuvre tout procédé de participation qui ne serait pas strictement conforme au présent règlement.
La Société Organisatrice se réserve le droit de disqualifier ou radier tout Participant qui altèrerait le bon fonctionnement du Jeu ou violerait les règles du Jeu.
Article 12 – Responsabilité
La responsabilité de la Société Organisatrice est strictement limitée à la délivrance des lots effectivement et valablement gagnés.
La Société Organisatrice se réserve le droit de modifier et/ou d’annuler le Jeu si des circonstances indépendantes de sa volonté l’exigeaient et sa responsabilité ne saurait être engagée de ce fait.
La Société Organisatrice ne saurait être tenue pour responsable d’éventuels dysfonctionnements ou à toute fraude, défaillance ou tout autre motif dépassant le contrôle de la Société Organisatrice.
La Société Organisatrice ne saurait notamment être déclarée responsable pour tout effacement, toutes erreurs, omissions, interruptions, perte de tout bulletin de tirage au sort, courrier électronique et plus généralement, de la perte de toute donnée de ce fait.
De même, sa responsabilité ne pourra être engagée si les bulletins de tirage au sort ne sont pas comptabilisés, sont incomplets ou impossibles à vérifier.
La Société Organisatrice se réserve la possibilité de modifier à tout moment le présent règlement et de prendre toutes décisions qu’il pourrait estimer utiles pour l’application et l’interprétation du présent règlement.
La Société Organisatrice se réserve également le droit de proroger, d’écourter, de modifier ou d’annuler le présent Jeu sans préavis, en raison d’événements indépendants de sa volonté et notamment en cas de force majeure ou cas fortuit.
Article 13 – Protection des données à caractère personnel
Le Participant est informé qu’Euraxi, en tant que responsable du traitement, met en oeuvre des traitements de données à caractère personnel, ayant pour finalité la gestion et le suivi du Jeu.
Euraxi, pourra également utiliser ces données pour des actions de communication et de prospection commerciale, sauf opposition de la part du Participant.
Les données ainsi collectées sont indispensables à ces traitements et sont destinées aux services concernés d’Euraxi, ainsi que, le cas échéant, à ses sous-traitants ou partenaires, et sont susceptibles d’être conservées pendant toute la durée de la relation commerciale et au maximum pendant 3 ans après le dernier contact.
Le Participant dispose d’un droit d’accès, de rectification ou d’effacement, d’un droit d’opposition au traitement, ainsi que du droit de définir des directives relatives au sort de ses données après décès, qui s’exercent par courrier électronique à contact@euraxi.com.com ou par courrier postal à l’attention d’Euraxi à l’adresse suivante : Euraxi, « Droit d’accès informatique et libertés », 10 rue Gutenberg, 37303 Joué-lès-Tours Cedex, accompagné d’une copie d’un titre d’identité.
Le Participant est informé de l’existence de la politique de confidentialité des données mise en oeuvre par Euraxi, également applicable dans le cadre du jeu « règlement cadre des tirages au sort » et accessible à l’adresse suivante : https://www.euraxi.fr/politique-de-confidentialite/
Article 14 – Propriété intellectuelle
La participation au présent Jeu n’emporte cession d’aucune sorte de droit de propriété intellectuelle sur les éléments disponibles sur le Jeu ou dans les bulletins de tirage au sort appartenant à Euraxi ou à ses partenaires au bénéfice du Participant.
Les créations, marques, logos, dessins, modèles, images, textes, photos, chartes graphiques ou toute autre information ou support présentés sur le Jeu, sans que cette liste soit exhaustive, sont la propriété exclusive d’Euraxi et/ou de ses partenaires et sont protégés par leurs droits d’auteurs, marques et tout autre droit de propriété intellectuelle qui leur sont reconnus selon les lois en vigueur.
Toute reproduction et/ou représentation de tout ou partie de ces éléments sans l’autorisation préalable écrite de leur propriétaire sont strictement interdites.
Article 15 – Modifications du présent règlement
Si les circonstances l’exigeaient, Euraxi se réserve le droit, sans engager sa responsabilité, de proroger, d’écourter ou de mettre fin, sans préavis, à ce Jeu.
Article 16 – Loi applicable
Le présent règlement est soumis à la loi française.
Dans ce livre blanc rédigé par le groupe de travail dédié de l’AFCROs dont fait partie Euraxi, découvrez les bénéfices de la décentralisation des essais cliniques mais également les pré-requis et les freins actuels au lancement de ces derniers.
Alors que des travaux sont menés par les autorités françaises (DGS / CNRIPH / CNIL / ANSM) et européennes (EMA) avec les parties prenantes, sur des recommandations sur la dématérialisation des essais cliniques, le groupe de travail Essais cliniques décentralisés a rédiger un livre blanc afin de déterminer les conditions optimales de réalisation d’un projet d’étude clinique décentralisée hybride à domicile.
Fruit de retours d’expérience, d’entretiens avec différentes parties prenantes et de points de vue des différents acteurs de la prise en charge, ce livre blanc a pour objectif de déterminer les conditions optimales de réalisation d’un projet d’étude clinique décentralisée hybride à domicile.
Un essai clinique est une étude scientifique réalisée sur des êtres humains. Il vise à évaluer la non-toxicité, la tolérance et l’efficacité d’une méthode diagnostique, d’un traitement ou d’une stratégie thérapeutique.
En effet, avant de proposer de nouveaux traitements à tous les patients concernés, il est impératif de prouver que ces nouveaux traitements sont efficaces et bien tolérés.
Parmi les essais cliniques, les “essais thérapeutiques” doivent notamment évaluer :
- de nouveaux médicaments ou associations de médicaments (contre la maladie ou ses effets secondaires), comparés dans certains cas aux traitements existants ;
- de nouvelles façons de les administrer (par comprimés plutôt que par injection, par exemple) ;
- de nouvelles techniques de traitement (nouveau type d’opération chirurgicale ou de radiothérapie, par exemple).
Ces études sont souvent effectuées après des études expérimentales non-cliniques (sur des modèles animaux ou cellulaires) pour confirmer leur pertinence et leur sécurité. Elles nécessitent aussi l’accord des autorités de santé et d’éthique du pays où elles ont lieu.
D’autres essais cliniques peuvent porter sur de nouvelles techniques de diagnostic (nouveau test biologique, par exemple) ou de prévention.
En fonction du type d’étude et du stade du développement du médicament ou du dispositif, les investigateurs enrôlent des volontaires sains ou des patients. Les études peuvent être monocentriques avec un faible nombre de participants (par exemple études pilotes).
À l’extrême inverse elles peuvent être multicentriques et inclure des milliers de patients.
La fiabilité de ces études repose sur une méthode scientifique rigoureuse et éprouvée afin de limiter tout biais, toute erreur de collecte des données ou d’interprétation des résultats.
Les Bonnes Pratiques Cliniques sont une norme internationale relative à la bioéthique s’appliquant aux essais cliniques réalisés sur des sujets humains.
Dans le cas des médicaments, les résultats obtenus servent à établir le dossier permettant d’en valider l’utilisation auprès d’instances nationales ou internationales.
Quelques exemples :
- Voir si un médicament est utile pour traiter une maladie donnée.
- Voir si la sécurité et l’efficacité d’une dose différente d’un médicament est plus adaptée.
- Voir si un médicament qui est déjà sur le marché peut également aider à traiter une autre maladie (pour lequel il n’avait pas été conçu, au début de son développement).
- Comparer des traitements pour voir lequel est le mieux à même de traiter une maladie donnée.
- Étudier la sécurité et l’efficacité d’un nouveau dispositif médical, par rapport à un traitement de référence.
- Évaluer un nouveau test de diagnostic par comparaison avec une méthode de référence.
- …
Le saviez-vous?
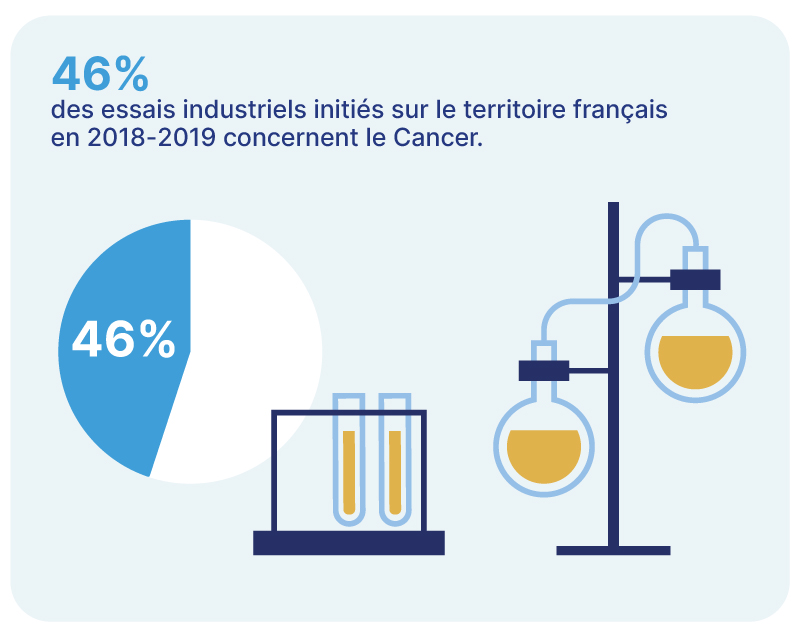
Source :
10ème enquête sur les essais cliniques : Accroître la position …
https://www.leem.org
L’équipe d’#Euraxi est à la recherche d’un(e) 👉 Senior Clinical Data Manager
🇫🇷 Leader dans la Recherche Clinique, nous renforçons notre équipe Biométrie.
• Temps plein, CDI
• Plusieurs possibilités d’implantations : sur site à Joué les Tours (37300) ou Télétravail 📍
• Salaire à définir en fonction du profil et de l’expérience
L’offre complète est à découvrir sur notre site et sur linkedin.
