Un essai clinique est une étude scientifique réalisée sur des êtres humains. Il vise à évaluer la non-toxicité, la tolérance et l’efficacité d’une méthode diagnostique, d’un traitement ou d’une stratégie thérapeutique.
En effet, avant de proposer de nouveaux traitements à tous les patients concernés, il est impératif de prouver que ces nouveaux traitements sont efficaces et bien tolérés.
Parmi les essais cliniques, les « essais thérapeutiques » doivent notamment évaluer :
- de nouveaux médicaments ou associations de médicaments (contre la maladie ou ses effets secondaires), comparés dans certains cas aux traitements existants ;
- de nouvelles façons de les administrer (par comprimés plutôt que par injection, par exemple) ;
- de nouvelles techniques de traitement (nouveau type d’opération chirurgicale ou de radiothérapie, par exemple).
Ces études sont souvent effectuées après des études expérimentales non-cliniques (sur des modèles animaux ou cellulaires) pour confirmer leur pertinence et leur sécurité. Elles nécessitent aussi l’accord des autorités de santé et d’éthique du pays où elles ont lieu.
D’autres essais cliniques peuvent porter sur de nouvelles techniques de diagnostic (nouveau test biologique, par exemple) ou de prévention.
En fonction du type d’étude et du stade du développement du médicament ou du dispositif, les investigateurs enrôlent des volontaires sains ou des patients. Les études peuvent être monocentriques avec un faible nombre de participants (par exemple études pilotes).
À l’extrême inverse elles peuvent être multicentriques et inclure des milliers de patients.
La fiabilité de ces études repose sur une méthode scientifique rigoureuse et éprouvée afin de limiter tout biais, toute erreur de collecte des données ou d’interprétation des résultats.
Les Bonnes Pratiques Cliniques sont une norme internationale relative à la bioéthique s’appliquant aux essais cliniques réalisés sur des sujets humains.
Dans le cas des médicaments, les résultats obtenus servent à établir le dossier permettant d’en valider l’utilisation auprès d’instances nationales ou internationales.
Quelques exemples :
- Voir si un médicament est utile pour traiter une maladie donnée.
- Voir si la sécurité et l’efficacité d’une dose différente d’un médicament est plus adaptée.
- Voir si un médicament qui est déjà sur le marché peut également aider à traiter une autre maladie (pour lequel il n’avait pas été conçu, au début de son développement).
- Comparer des traitements pour voir lequel est le mieux à même de traiter une maladie donnée.
- Étudier la sécurité et l’efficacité d’un nouveau dispositif médical, par rapport à un traitement de référence.
- Évaluer un nouveau test de diagnostic par comparaison avec une méthode de référence.
- …
Le saviez-vous?
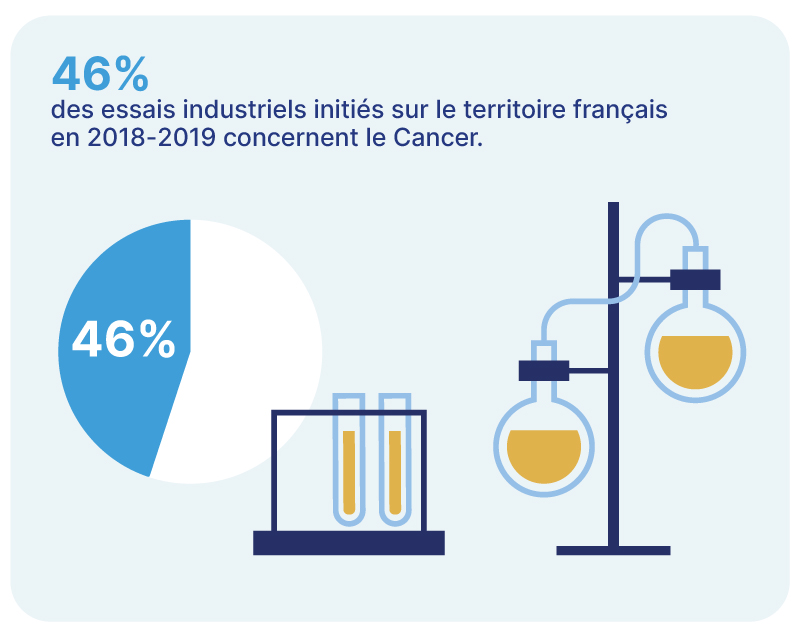
Source :
10ème enquête sur les essais cliniques : Accroître la position …
https://www.leem.org
Le numéro de janvier/février de DeviceMed est paru !
Découvrez l’article d’Odile Capronnier, rédactrice médicale et Elsa Llobet Merkling, responsable affaires réglementaires chez Euraxi sur les Investigations cliniques « Quels circuits réglementaires depuis le 26 mai 2021 ? »

